Fabio Caradonna
Ricercatore di Genetica
Professore aggregato di Genetica e Citogenetica umana
Dipartimento di Scienze e Tecnologie Biologiche Chimiche e Farmaceutiche (STEBICEF – Sezione di Biologia cellulare)
Università di Palermo
Email: fabio.caradonna@unipa.it
L’immaginario collettivo non ha un’opinione buona e nemmeno benevola sui batteri. Sono spesso legati a concetti di mancanza di igiene, malattie ed a volte anche a situazioni più gravi financo la morte. E’ indubbio che alcuni generi di procarioti sono agenti patogeni di specifiche malattie infettive che, in passato più che oggi, hanno mietuto vittime nel genere umano. Ma che dire dei batteri lattici degli yogurt o della nostra flora batterica intestinale? C’è da aggiungere anche una lunga serie di organismi procarioti, non patogeni, che hanno, negli ultimi due secoli, costituito sistemi biologici idonei allo studio della biologia molecolare e della genetica molecolare. In definitiva è molto più lunga la lista di batteri “amici” dell’uomo a vario titolo, che quelli temibili patogeni.

Fig. 1 – Geyser del Parco di Yellowstone dove è stato isolato il batterio Thermophylus aquaticus.
Ad esempio da molti batteri Escherichia coli ed altri è stato possibile estrarre gli enzimi di restrizione di tipo II che a partire dagli anni settanta hanno permesso l’inizio dell’ingegneria genetica. Il batterio termofilo Thermophylus aquaticus, vivente ad alte temperature (72 °C) nelle solfatare e nei geyser americani (Fig. 1) ha consentito di ottenere enzimi termostabili polimerizzanti il DNA (Taq DNA polimerasi) utili allo sviluppo dell’innovativa tecnica “Reazione di polimerizzazione a catena del DNA” (Polymerase Chain Reaction – PCR) per la quale K. Mullis ottenne il premio Nobel per la chimica nel 1993 e che ha rivoluzionato le potenzialità delle analisi genetico-molecolari sul DNA in tutto il mondo.
Negli anni duemila, studiando l’eterna lotta fra predatore/preda nei batteri infettati da virus batteriofagi (fagi) abbiamo potuto isolare gli enzimi di restrizione metilazione-sensibili e quindi condurre i primi studi sulla modificazione chimica del DNA non di sequenza, favorendo la nascita dell’Epigenetica (una branca della genetica che si occupa dell’interazione DNA-ambiente). Anche recentemente, studiando a fondo il modo con cui determinati batteri si difendono dall’infezione dei loro rispettivi fagi gli studiosi hanno scoperto qualcosa che probabilmente darà un forte impulso alla manipolazione del DNA direttamente sul vivente (la cosiddetta mutagenesi mirata).
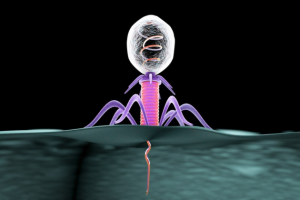
Fig. 2 – Rappresentazione di un’infezione fagica su un batterio.
E’ noto che un virus specifico infetta un batterio iniettando il proprio DNA al suo interno (Fig. 2) e determinando, con massima probabilità, la sua morte per lisi; stranamente però, alcuni studiosi notarono che determinati batteri Streptococcus pyogenes, per quanto infettati, non andavano in lisi, quasi come se avessero combattuto e vinto la battaglia contro il virus. Pochi anni fa, in piena epoca del sequenziamento genomico di DNA si scoprì che alcuni ceppi batterici contenevano nel loro cromosoma tratti di DNA di virus intervallati da un DNA spaziatore. Queste sequenze furono denominate C.R.I.S.P.R. (Clustered Regularly Interspaced Short Palindromic Repeats). Esse rappresentano fondamentalmente un archivio di sequenze utili al batterio già infettato e sopravvissuto per combattere infezioni future da fagi. Infatti, in caso di altre infezioni da parte dello stesso virus, le sequenze CRISPR sono trascritte in corti RNA guida (con sequenza complementare al genoma virale), ai quali si abbina una ribonucleoproteina altamente specifica: l’enzima Cas9.
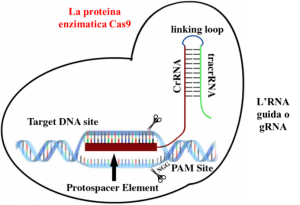
Fig. 3 – Schema di un sistema CRISPR – Cas9 e della sua azione.
Appaiandosi alla sequenza complementare sul DNA virale, l’RNA guida Cas9 sul bersaglio: il DNA virale viene digerito (Fig. 3) e l’infezione arginata: un protosistema immunitario “a cassette” nei batteri.
Apprendendo e studiando questo sorprendente modo di neutralizzare un DNA pericoloso semplicemente riconoscendolo e tagliandolo, gli studiosi hanno “esportato” questo sistema su altri DNA rendendo possibile il “genome editing” cioè il riconoscimento e cambiamento di un DNA con un altro appositamente sintetizzato. E’ diventato teoricamente quindi possibile inserire, nel genoma di una qualunque cellula un DNA esogeno non mutato in grado di bloccare o attenuare l’espressione di un corrispondente gene endogeno, per esempio, mutato, oppure, inserire un DNA esogeno in grado di bloccare l’espressione del gene endogeno e contemporaneamente esprimere se stesso. Il tutto con una efficienza notevolmente più alta che con i sistemi fino ad ora utilizzati: vettori retrovirali, liposomi, etc.
Una recentissima pubblicazione ha definito i CRISPR come un salto in avanti per la ricerca biomedica [1]. Ed infatti, nel giro di pochi anni dalla loro scoperta (2012), la tecnologia CRISPR è diventata il goal standard per modificare la sequenza primaria di un DNA e modularne l’espressione genica, soprattutto nella ricerca biomedica e nella terapia sperimentale. Inoltre, il rapido progresso della tecnologia CRISPR ha fatto iniziare numerosi studi di terapia genica sull’uomo in tutto il mondo. Infatti, in un futuro vicino, usando i CRISPR, sarà possibile:
- ottenere una modellizzazione di alcune patologie per generazione di cellule mutate in particolari siti del DNA e comprendere i meccanismi patogenetici senza doverli indagare su pazienti;
- facilitare la progettazione di un farmaco, definire strategie cliniche ed anche accelerare la scoperta di un efficace trattamento mirato e cura di una determinata malattia genetica;
- studiare regioni cromosomiche non codificanti ma candidabili/candidate a sequenze-malattia.
Il tutto con una sensibilità e specificità maggiore (il sistema richiede DNA da indagare nell’ordine dei femtomoli, cioè di una quantità pari a 1000 miliardesimi di litro) e con costi di esecuzione compatibili con un metodo da screening di massa: prezzo di una singola reazione da 0,1 a 1,0 USD [2].
Lanciata la strategia innovativa tutte le più famose ditte biotecnologiche hanno iniziato studi per ottimizzare il sistema ottenendo batteri mutanti per i geni Cas nei quali la proteina Cas riconosce ma non taglia (catalically-dead Cas) il DNA, aprendo nuovi scenari in diagnostica molecolare basata sul solo riconoscimento di sequenze. Anche la terapia genica potrà avere un impulso dall’uso dei CRISPR-Cas9: è infatti ipotizzabile il loro uso per sostituire un gene mutante con uno selvatico in cellule di un soggetto, che, dopo correzione, potrebbero essere trasfuse o reimpiantate allo stesso soggetto.
Oggi sono presenti studi affermati su modelli di topo nei quali è stato dimostrato, con il sistema CRISPR l’eradicazione della malattia minima residua da HBV (Virus dell’epatite B), sono in corso analoghi studi per l’HIV (virus dell’AIDS) e si è ottenuta guarigione da ipercolesterolemia congenita. Sull’uomo abbiamo notizia dell’avvio di un primo CRISP-trial clinico su una malattia rara: la forma più comune di Amaurosi congenita di Leber, una grave distrofia retinica causata da una mutazione nel gene CEP290.
Teoricamente, ingegnerizzando ovocellule con CRISPR-Cas9 si possono creare animali vitali o cellule da usare come modelli animali di patologie da studiare al posto dei pazienti. Per esempio si possono indurre cardiopatie ischemiche in nuovi nati di topi o primati [3]. I CRISPR Cas9 possono anche essere utili in agricoltura: per esempio si potrebbero ingegnerizzare solanacee (pomodoro), tabacco e petunie per resistere a patogeni evitando così l’uso di pesticidi [4].
I CRISPR sono già…..in vendita nel senso che esistono già in commercio dei kit, ad uso dei laboratori di genetica molecolare che facilitano il loro utilizzo nell’adattamento ai vari sistemi biologici degli sperimentatori.
Le loro grandissime potenzialità hanno fatto anche opinione ed ecco perché i CRISPR …. sono già in libreria. Un’autrice scientifica descrive in maniera divulgativa il sistema e pone anche inevitabili ma doverose questioni bio-etiche. Infatti c’è da dire che intuendo le enormi potenzialità è bene aumentare anche le conoscenze su questi sistemi prima di procedere ad un loro uso generalizzato. Ad oggi la tecnologia CRISPR-Cas9 non è ancora così efficiente da poter realizzare tutti i «desideri». Inoltre, bisogna, in ogni tempo ed oggi in particolare, tenere presente un principio bioetico-scientifico che invita lo sperimentatore a considerare con umiltà che qualche sfida potrebbe non essere mai alla sua portata o socialmente utile.
Se da un lato i CRISPR-Cas9, tenendo fede anche solo a una piccola parte delle loro potenzialità, renderanno possibili un’infinità di esperimenti, regalandoci conoscenze, farmaci, ed in generale prodotti capaci di migliorare la qualità della vita, dall’altro lato pongono perplessità per le quali è saggio prevedere meccanismi di salvaguardia e tutela. I problemi, da sempre sollevati quando si parla di DNA trasmissibile generazionalmente (quale quello delle ovocellule), oggi incrementati dalla scoperta dei CRISPR, non sono una questione da poco. Quando sapremo cambiare i geni di un genoma (umano) a piacimento, come faremo a impedire che questa tecnica cada nelle mani sbagliate? Esiste il pericolo che vengano progettati «bambini su misura»? Sarebbe un sogno o un incubo se «l’uomo creasse l’uomo»? [5]. Oggi sono noti effetti collaterali dei sistemi CRISPR: possono indurre ricombinazioni aspecifiche, indurre aberrazioni cromosomiche. I problemi di sicurezza causati da tagli e riparazioni non specifici di DNA dei sistemi CRISPR devono essere accuratamente investigati, compresi e gestiti, se non completamente risolti, prima che si possa riporre speranze concrete sugli usi terapeutici: le migliori aziende multinazionali biotecnologiche sono già al lavoro per questo.
I CRISPR mostrano un grande potenziale per curare le malattie genetiche, con una speranza molto realistica di eliminarne qualcuna in futuro ma deve essere sempre tenuto presente il principio fondamentale della ragionevolezza scientifica: “non tutto ciò che è tecnicamente possibile fare, è anche lecito fare”.
Concludendo, non possiamo non rivolgere un sentito ringraziamento ai batteri, organismi evoluzionisticamente vincenti sull’intero pianeta dai quali abbiamo sempre avuto soluzioni per migliorare il nostro stato di salute generale (gli antibiotici, ad esempio, ma non solo): in particolare, li ringraziamo per averci, negli ultimi 100 anni, fornito conoscenze su fenomeni genetico-molecolari generali ed applicati alla vita dell’uomo.
Una lezione data a ciascuno di noi di come ogni vivente su questo pianeta abbia una dignità pari a quella umana nel suo ambiente specifico: non esistono, infatti, organismi «peggiori» o «migliori» ma tutta la biosfera, tutti i viventi, devono essere apprezzati e ritenuti preziosi e da salvaguardare.
Bibliografia essenziale
- Collins PJ, Hale CM, Xu H. Edited course of biomedical research: leaping forward with CRISPR. Pharmacol Res. 2017 Nov;125(Pt B):258-265.
- Pardee K, Green AA, Takahashi MK, Braff D, Lambert G, Lee JW, Ferrante T, Ma D, Donghia N, Fan M, Daringer NM, Bosch I, Dudley DM, O’Connor DH, Gehrke L, Collins JJ. Rapid, Low-Cost Detection of Zika Virus Using Programmable Biomolecular Components. 2016 May 19;165(5):1255-1266.
- Motta BM, Pramstaller PP, Hicks AA, Rossini A. The Impact of CRISPR/Cas9 Technology on Cardiac Research: From Disease Modelling to Therapeutic Approaches. Stem Cells Int. 2017; 2017:8960236.
- Yamamoto T, Kashojiya S, Kamimura S, Kameyama T, Ariizumi T, Ezura H, Miura K. Application and development of genome editing technologies to the Solanaceae plants. Plant Physiol Biochem. 2018 Mar 2. pii: S0981-9428(18)30071-8.
- Meldolesi C. L’uomo creò l’uomo. Bollati Boringhieri editore, 2017.
Profilo dell’autore
Fabio Caradonna, biologo e dottore di ricerca in Biologia cellulare e dello sviluppo, è attualmente ricercatore confermato a tempo indeterminato di Genetica e docente di Genetica e Citogenetica umana presso l’Università degli Studi di Palermo. È valutatore di progetti regionali, nazionali, europei ed industriali. È esperto di genetica, citogenetica ed epigenetica. È autore o coautore di 35 lavori su riviste internazionali quotate ISI, di 3 lavori su riviste nazionali, di 12 capitoli di libri, di 1 curatela di volume scientifico e di 60 abstract a congressi nazionali e internazionali.